ESTÁNDARES DE APRENDIZAJES UNIT 1:
E.A.2.6.1. Representa el átomo, a partir del número atómico y el número másico, utilizando modelo planetario. CMCT, CAA
E.A.2.6.1. Representa el átomo, a partir del número atómico y el número másico, utilizando modelo planetario. CMCT, CAA
E.A.2.6.2. Describe
las características de las partículas subatómicas básicas y su localización en
el átomo. CMCT, CAA
E.A.2.6.3. Relaciona
la notación con el número atómico, el número másico determinando el número de
cada uno de los tipos de partículas subatómicas básicas. CMCT, CAA
E.A.2.7.1. Explica en
qué consiste un isótopo y comenta aplicaciones de los isótopos radiactivos, la
problemática de los residuos originados y las soluciones para la gestión de los
mismos. CCL, CAA, CSC
E.A.2.9.1. Conoce y
explica el proceso de formación de un ion a partir del átomo correspondiente,
utilizando la notación adecuada para su representación. CCL, CMCT, CAA
THE ATOMIC STRUCTURE
OF MATTER
1. DALTON’S ATOMIC THEORY (number 2 in the text book)
2. THE DISCOVERY OF ELECTRON AND RADIOACTIVITY (3)
3. ATOMIC MODELS (4)
4. SUBATOMIC PARTICLES (5)
5. ISOTOPES AND THEIR APPLICATIONS (6)
6. THE SHELLS OF ATOMS AND IONS (7)
What do you think it is?
1. DALTON’S ATOMIC THEORY (2)
Everything that surrounds us is made of atoms. Matter is discontinuous. It means that it can
be divided in smaller particles. The more we divide, the smaller the particles.
Substance or object -> Molecule -> Atoms -> Subatomic particles
Atoms are tiny particles which form all the matter in the universe. Particle means very small
particle. Atoms cannot be seen with optical microscopes but electronic ones, which have
Atoms have been studied by many scientists throughout history. The first ones were the philosophers in ancient Greece (VI century b.C.).
The word atom comes from the Greek and means indivisible. The concept was introduced by philosophers of ancient Greece, such as Democritus and Leucippus, but it took more than 2000 years for these theories to become an modern atomic theory.
Dalton’s hypotheses: AUDIO
Between 1803 and 1808, the English scientist John Dalton proposed his ideas about the compostion of matter. To do so, he used an idea from Classical Greece: The atom.
1)
Matter is formed of tiny and indivisible particles called atoms.
2)
Atoms of a given chemical element are identical. They share identical mass and
properties (such as chlorine).
The
atoms of a given element are different from those of any other chemical element because they have got different mass and properties (such as sodium atoms are different from chlorine atoms).
3)
The atoms of different elements combine to form chemical compounds. For
example, two hydrogen atoms (H) join with one oxygen atom (O) to form molecule
of water (H2O)
So,
molecules are made of atoms with a certain proportion between the atoms in a
simple numerical relationship. H2O 2:1 H:O
4)
In a chemical reaction, atoms of different elements reorder to form new
compounds.
Nowadays,
atom and molecule are defined in this way:
Atom: a
unit of matter, the smallest unit of an element which can take part in a
chemical reaction.
Examples:
Fe, Ar, N, H, O, Mn. (symbols only in capital letters and no subscript)
Molecule:
a group of two or more atoms linked by a chemical bond.
Examples: N2, H2, O2, P4, H2O, CO. (Fornula and subscript)
With which chemical law can we relate the fourth hypothesis of Dalton's atomic theory? And the third hypothesis? The law of conservation of mass (Lavoisier). The law of definite proportion (Proust).
2. THE DISCOVERY OF ELECTRON AND RADIOACTIVITY (3)
During the 19th century:
- Dalton had determined
that matter was formed of indivisible atoms. AUDIO
- In 1897, J.J. Thomson studied some “mysterious rays” (cathode rays) that appeared in glass tubes containing gas when electric shocks. Cathodes rays are the same for all gases in the tube and found that these rays were formed by particles with very low masses and negative electric charges, called ELECTRONS, which are present in all atoms.
- In 1897, J.J. Thomson studied some “mysterious rays” (cathode rays) that appeared in glass tubes containing gas when electric shocks. Cathodes rays are the same for all gases in the tube and found that these rays were formed by particles with very low masses and negative electric charges, called ELECTRONS, which are present in all atoms.
- Different
experiences showed that the particles could gain or lose electrical charges.
- In 1909, Robert
Millikan determined the charge of the electron: 1,6.10-19 C
- Several scientists
(Roetgen, Becquerel and Madame Curie) observed emission from some (radioactive)
substances: radioactivity.
There are three types of radioactivity: alpha (a), beta (b) and gamma (g). They have different charges and penetrative abilities.
There are three types of radioactivity: alpha (a), beta (b) and gamma (g). They have different charges and penetrative abilities.
(J.J.THOMSON, NO THOMPSON)
- Finally, James Chadwick in 1932, discovered a third particle without electric charge and same
mass as proton and called NEUTRON.
3. ATOMIC MODELS (4) AUDIO
A. THE THOMSON MODEL ("Plum pudding model")
The atom is formed by a solid body with a positive charge, to which electrons of negative charge are encrusted. Together they have a neutral charge.
El átomo es una gran masa de carga positiva en la que se insertan los electrones. Debido a la repulsión entre los electrones, estos se distribuyen uniformemente en la esfera. La carga negativa de los electrones se compensa con la positiva para que el átomo sea neutro. (Modelo del pastel de pasas)
The atom is formed by a solid body with a positive charge, to which electrons of negative charge are encrusted. Together they have a neutral charge.
El átomo es una gran masa de carga positiva en la que se insertan los electrones. Debido a la repulsión entre los electrones, estos se distribuyen uniformemente en la esfera. La carga negativa de los electrones se compensa con la positiva para que el átomo sea neutro. (Modelo del pastel de pasas)
B. THE RUTHERFORD MODEL ("Nuclear model"):
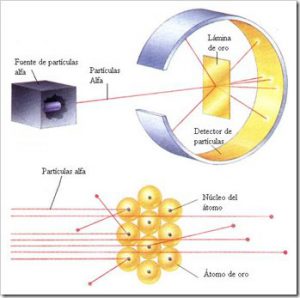
Este físico y químico neozelandés dedicó su vida al estudio de las partículas radiactivas y a él le debemos el famoso experimento de la lámina de oro que, en realidad, realizó para probar el modelo atomico de Thomson.
En el interior de un bloque de plomo se hizo una cavidad con una salida al exterior en la que se colocó material radiactivo que producía los rayos alfa (recientemente Henri Becquerel había descubierto la radiactividad o la emisión espontánea de partículas alfa emitidas por un mineral de uranio). Todos los rayos que no tuviesen la dirección del orificio de salida serían absorbidos por el plomo. Para conocer la trayectoria que seguían las partículas alfa después de chocar se rodeó esta con una película fotográfica.
Se obtuvieron los siguientes resultados:
Se obtuvieron los siguientes resultados:
- La mayoría de las partículas alfa atravesaban la lámina de oro sin desviarse. (La mayor parte del átomo está vacío)
- Una pequeña proporción de partículas atravesaba la lámina, pero sufría una leve desviación. (Aquellas partículas que pasaban cerca del núcleo).
- Una de cada 10. 000 partículas alfa rebotaba al llegar a la lámina y volvía hacia atrás. (Una pequeñísima parte de las partículas chocaron con el núcleo).
Luego, debía existir en el átomo una zona con alta densidad de carga positiva, descubrió así el núcleo atómico.
(Notas: Las partículas alfa son núcleos de helio, por tanto, con carga positiva)
(Notas: Las partículas alfa son núcleos de helio, por tanto, con carga positiva)
- THE RUTHERFORD's MODEL:
The positive charge of the atom is concentrated in the nucleus. Electrons orbit around the nucleus like planets around the Sun. Most of the atom is empty.
En el interior del átomo se encuentra un núcleo muy pequeño en comparación con el tamaño total del átomo, del orden de 10-14 m, en el que se concentra su carga positiva. Los electrones se encuentran en la corteza girando y describiendo órbitas circulares alrededor del núcleo atómico, como los planetas alrededor del Sol (por ello también se le conoce como modelo planetario). La corteza es del mismo orden de magnitud que el átomo, 10-10 m
En el interior del átomo se encuentra un núcleo muy pequeño en comparación con el tamaño total del átomo, del orden de 10-14 m, en el que se concentra su carga positiva. Los electrones se encuentran en la corteza girando y describiendo órbitas circulares alrededor del núcleo atómico, como los planetas alrededor del Sol (por ello también se le conoce como modelo planetario). La corteza es del mismo orden de magnitud que el átomo, 10-10 m
Según la mecánica clásica y la teoría electromagnética una carga en movimiento circular emitiría energía, por tanto los electrones acabarían cayendo en espiral atraídos hacia el núcleo positivo. Este "problema de estabilidad" creó la necesidad de postular un nuevo modelo atómico.
Cuando Rutherford estableció su modelo, no se conocía aún el neutrón. La siguiente imagen muestra el átomo teniendo en cuenta el modelo propuesto por Rutherford (1911) y la inclusión del neutrón descubierto por Chadwick en 1932.
C. THE BOHR MODEL:
En 1913, Niels Bohr realizó una serie de estudios y dedujo que el átomo está cuantizado: los electrones se organizan en niveles energéticos que tienen una capacidad limitada: órbitas estacionarias.
- Los electrones se encuentran en capas electrónicas, girando en órbitas circulares bien definidas y estables, sin emitir ni absorber energía.
- En el caso de absorber o emitir energía, un electrón puede saltar de una órbita a otra.
Así, caben 2 electrones en el primer nivel (capa K, la más cercano al núcleo), 8 en el segundo (L), 18 en el tercero (M) y en el cuarto nivel de energía puede haber hasta 32 electrones,... Para calcular el número de electrones máximo en cada nivel se utiliza la siguiente expresión, donde n es el número cuántico principal que corresponde con el nivel energético: 2n2
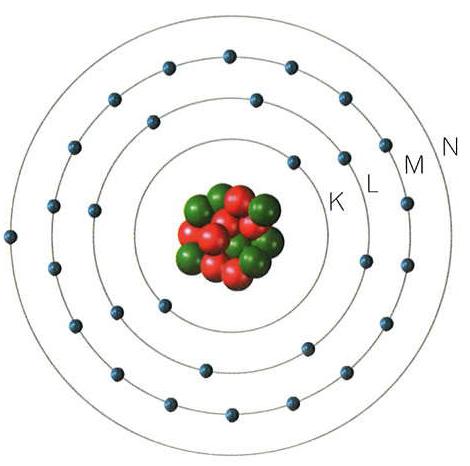
- Los electrones se encuentran en capas electrónicas, girando en órbitas circulares bien definidas y estables, sin emitir ni absorber energía.
- En el caso de absorber o emitir energía, un electrón puede saltar de una órbita a otra.
Así, caben 2 electrones en el primer nivel (capa K, la más cercano al núcleo), 8 en el segundo (L), 18 en el tercero (M) y en el cuarto nivel de energía puede haber hasta 32 electrones,... Para calcular el número de electrones máximo en cada nivel se utiliza la siguiente expresión, donde n es el número cuántico principal que corresponde con el nivel energético: 2n2
Nivel 1 n=1 (capa K) Caben hasta 2 electrones
Nivel 2 n=2 (capa L) Caben hasta 8 electrones
Nivel 3 n=3 (capa M) Caben hasta 18 electrones., etc

In 1913, Bohr proposed his quantized shell model of the atom. Based on the Rutherford model, with one fundamental modification: the electrons are in specific orbits, called stationary orbits, where they are stable.
To remedy the stability problem, Bohr modified the Rutherford model by requiring that the electrons move in orbits of fixed size and energy. The energy of an electron depends on the size of the orbit and is lower for smaller orbits. Radiation can occur only when the electron jumps from one orbit to another (by absorbing or emitting energy). The atom will be completely stable in the state with the smallest orbit, since there is no orbit of lower energy into which the electron can jump.
IDEAS CLARAS:
* DIFERENCIAS ENTRE MODELOS ATÓMICOS SON:
- PARA THOMSON EL ÁTOMO ES MACIZO, PARA RUTHERFORD Y BOHR, NO (ES HUECO).
- A PARTIR DE BOHR SE HABLA DE NIVELES DE ENERGÍA EN LA CORTEZA DONDE LOS ELECTRONES ORBITAN
* ANALOGÍA: LOS TRES MODELOS VISTOS PUEDEN EXPLICAR LA FORMACIÓN DE IONES.
D. THE QUANTUM MECHANICAL MODEL OF THE ATOM (Schrödinger).
Different types of orbitals (zone with high probability of finding an electron ) are identified with the letters s, p, d and f, The shape and size of the orbital depend on the level and sublevel of energy where the electron is found.
En siguientes cursos verás que órbita no es lo mismo que orbital.
REWIEW:
VIDEO RESUMEN:
VIDEO RESUMEN:
ACTIVIDADES MODELOS ATÓMICOS:
1. Realiza una línea de tiempo con todos los hitos, fechas y científicos implicados.
2. Según lo visto, ¿a qué modelos corresponden las siguientes imágenes?
(Es el ejercicio 9 de la pág 48)

3. Explica el experimento de la lámina de oro de Rutherford.
4. Actividades del libro. Pág 48: 6, 7, 10 y 11.
4. SUBATOMIC PARTICLES (5) AUDIO
Pág 49: Ejercicio 11. Tabla resumen.
Por tanto, el átomo es una estructura con un núcleo muy pequeño en relación al tamaño total del átomo. En el núcleo se encuentran los protones (Z) y neutrones (N). Alrededor del núcleo se mueven los electrones a una distancia muy grande a comparación con el tamaño de este. Es decir, la mayor parte del átomo está vacía.
Para representar un átomo se utiliza un símbolo con dos números: el número atómico, Z, que indica el número de protones y es el "DNI del átomo" y el número másico, A, indica su número de protones más el de neutrones.
- En un átomo neutro, el número de protones coincide con el número de electrones. Por tanto, conociendo Z también podremos conocer el número de electrones de un átomo neutro.
- Todos los átomos de un elemento químico tienen el mismo Z, es decir, todos tienen el mismo número de protones.
VIDEO: ATOMS (Enciclopedia británica)
VIDEO: ATOMS (Enciclopedia británica)
ACTIVIDAD INTERACTIVA CONSTRUIR ÁTOMOS
ACTIVIDADES SOBRE EL NÚCLEO ATÓMICO - MAGNITUDES NUCLEARES AZN:
Pág. 49: 14, 15, 16, 18 y 20.
5. ISOTOPES AND THEIR APPLICATIONS (6) AUDIO
ACTIVIDADES SOBRE EL NÚCLEO ATÓMICO - MAGNITUDES NUCLEARES AZN:
Pág. 49: 14, 15, 16, 18 y 20.
5. ISOTOPES AND THEIR APPLICATIONS (6) AUDIO
ISOTOPES: Atoms that have the same number of protons but different numbers of neutrons. In those cases, the atomic number, Z, is the same but they have different atomic masses, A.
Examples: Potasium-39 and potasium-41.
Carbon-12, carbon-13 and carbon-14
H-1 (protio), H-2 (deuterio) y H-3 (tritio)
Carbon-12, carbon-13 and carbon-14
H-1 (protio), H-2 (deuterio) y H-3 (tritio)
ISOTOPE means ISO = same + TOPE = place (because the isotopes of a chemical element occupy the same place in the periodic table).
IDEA CLARA: Isotopos son conjuntos de átomos de un elemento químico que tienen el mismo número de protones (igual Z), pero distinto número de neutrones en el núcleo (distinto N, luego distinto A).
Although there are many applications of isotopes, we highlight the following ones: a) Medicine:
- Diagnosis: Diagnostic techniques in nuclear medicine use radiopharmaceuticals (or radiotracers) which emit gamma rays from within the body.
- Therapy: Nuclear medicine is also used for therapeutic purposes. Most commonly, radioactive iodine (I-131) is used in small amounts to treat cancer and other conditions affecting the thyroid gland. They are also used in the treatment of malignant tumors but the absorbed radiation can also kill healthy cells.
- Sterilisation: Hospitals use gamma radiation to sterilise medical products and supplies such as syringes, gloves, clothing, and instruments that would otherwise be damaged by heat sterilisation.
b) Carbon dating: Analysing the relative abundance of particular naturally-occurring radioisotopes is of vital importance in determining the age of rocks and other materials that are of interest to geologists, anthropologists, hydrologists, and archaeologists, among others.
Carbon-14 dating is the most famous method, because the amount of this isotope is measured. There are two disadvantages: only organic tissues are supported and the remains must be more recent than 50000 years.
c) Other applications: agriculture (fertilisers, insect control, plant mutation breeding), industry, food, ...
Radiactive waste or nuclear waste must be handled by specialized personnel with adequate protection.
Pág. 42: Ejercicios resueltos 5 y 6
ACTIVIDADES SOBRE ISÓTOPOS:
1. ¿QUÉ SON LOS ISÓTOPOS? ¿QUÉ APLICACIONES TIENEN? PON EJEMPLOS. (Es un resumen del punto 6 del libro)
2. PÁG. 43: 22 y 23.
3.Final del tema. PÁG. 49: 14, PÁG. 50: 21 y 23.
4. PÁG. 51: Física cotidiana: "Los residuos nucleares".
6. THE SHELLS OF ATOMS AND IONS (7) AUDIO
Electrons fill the shell of an atom in energy levels. Not all the energy levels can hold the same number of electrons.
- The K layer (level 1) fits 2 electrons.
- The L layer (level 2) fits 8 electrons.
- The M layer (level 3) fits 18 electrons.
- The N layer (level 4) fits 32 electrons.
Copyright: Gentileza de David N.C.
Electrons fill the shell of an atom in energy levels. Not all the energy levels can hold the same number of electrons.
- The K layer (level 1) fits 2 electrons.
- The L layer (level 2) fits 8 electrons.
- The M layer (level 3) fits 18 electrons.
- The N layer (level 4) fits 32 electrons.
Los electrones se colocan en el átomo ocupando el nivel de menor energía que esté libre. Si un átomo o ion tiene un solo electrón, este se situará en el primer nivel de energía,el más cercano al núcleo.
Con el modelo de Rutherford se pueden explicar los iones:
- Cuando un átomo pierde electrones, adquiere carga positiva y se convierte en ion positivo o catión.
- Cuando un átomo gana electrones, adquiere carga negativa y se convierte en ion negativo o anión.
VIDEO: History Summary
* ACTIVIDADES SOBRE CORTEZA ELECTRÓNICA:
1. ¿Qué es un ion? ¿Qué tipos hay? Pon ejemplos
Nos centraremos en:
Pág. 45: 28, 29 y 30
Pág. 50: 28, 29, 30 y 31
* ACTIVIDADES SOBRE CORTEZA ELECTRÓNICA:
1. ¿Qué es un ion? ¿Qué tipos hay? Pon ejemplos
Nos centraremos en:
Pág. 45: 28, 29 y 30
Pág. 50: 28, 29, 30 y 31
CONFIGURACIONES ELECTRÓNICAS:
En el siguiente diagrama (DIAGRAMA DE MOELLER) se relacionan los orbitales que hay en cada nivel. Además, te ayudará para realizar la configuración electrónica de un átomo (principio de construcción o de Aufbau). Se llama configuración electrónica a la distribución de los electrones de un átomo en niveles y subniveles energéticos.
Se denomina configuración electrónica de un átomo al modo en que están distribuidos los electrones alrededor del núcleo de ese átomo. Reglas:
- En cada orbital solo puede haber dos electrones, pero en distinto estado cuántico (Principio de exclusión de Pauli). Ej: Berilio.
- Los electrones se van colocando en el átomo ocupando el orbital de menor energía que esté vacante (Principio de prioridad de los estados de mínima energía).
- Se colocan primero los electrones que estén girando en el mismo sentido de modo que haya el máximo posible de electrones desapareados (Regla de Hund o de máxima multiplicidad) Ej: Nitrógeno.
Se denomina electrón de valencia a los electrones responsables del comportamiento químico de los átomos. Son los electrones situados en el último nivel.
Los gases nobles tiene completa su última capa (octete electrónico), lo que le confiere gran estabilidad y son inertes, químicamente hablando.
Los gases nobles tiene completa su última capa (octete electrónico), lo que le confiere gran estabilidad y son inertes, químicamente hablando.
VIDEO: Puedes ver como se realiza la configuración electrónica
- SOBRE IONES:
1. ¿QUÉ ES UN ION? ¿QUÉ TIPOS DE IONES HAY?
2. PÁG. 45: EJERCICIOS RESUELTOS, 28, 29 Y 30.
3. PÁG. 50: 24, 25, 26, 27, 28, 29, 30, 31 y 32.
VIDEO: Atoms and Moeller diagram
OTRAS ACTIVIDADES (REPASO 3º Y 4º ESO)

2) ¿En qué consistió la experiencia de Rutherford de la lámina de oro? ¿Por qué fue tan crucial e importante?
3) ¿De qué nos informa la siguiente notación referida a un elemento químico?
(Error: 2-)
4) ¿Qué es un isótopo? Representa y explica:
a) el conjunto de isótopos del hidrógeno (hidrógeno-1, hidrógeno-2 e hidrógeno-3).
b) los átomos isótopos del carbono: C-12, C-13 y C-14.
Datos: Hidrógeno Z = 1; Carbono Z = 6
5) ¿Qué son los iones? ¿Qué dos tipos hay? Pon ejemplos.
6). Realiza una tabla en la que indiques A, Z, número de protones, electrones y neutrones de los isótopos del carbono (carbono-12, carbono-13 y carbono-14).
7) Escribe la configuración electrónica de los siguientes átomos e iones: 73Li, 2311Na, 3913K, 2010Ne, 199F-1,2412Mg2+, 2713Al3+
8) Realiza una tabla en la que indiques el número atómico, la configuración electrónica, la capa de valencia y el número electrones de valencia de los siguientes elementos: Fósforo, Cloro, Calcio, Oxígeno, Estaño, Aluminio, Xenón y Rubidio.
9) Realiza una tabla en la que indiques el átomo, los protones, los electrones, la configuración electrónica, el grupo, la familia, el período y el carácter metálico de los siguientes elementos: Ne, F, O, I, Be, B y Fe.
Para saber más...



























No hay comentarios:
Publicar un comentario