Los átomos. Sistema periódico y enlace químico.
- Constitución
del átomo.
- Número
atómico, número másico e isótopos de un elemento.
- Modelo
atómico de Bohr. Modelo atómico actual.
- Distribución
de los electrones en un átomo.
- El
sistema periódico de los elementos.
- Propiedades
periódicas de los elementos.
- Enlace
iónico. Propiedades de los compuestos iónicos.
- Enlace
covalente. Propiedades de los compuestos covalentes.
- Enlace
metálico. Propiedades de los metales.
- Formulación y nomenclatura de compuestos sencillos según la IUPAC. (Tema siguiente)
¿Qué representa la siguiente imagen?
Observa el siguiente gif.
Cierra los ojos, ¿dónde se encuentran las moscas? ¿Qué dirías?
¿Y si en lugar de moscas fueran electrones?
1. PARTÍCULAS SUBATÓMICAS.
La palabra átomo proviene del griego y significa indivisible. El concepto fue introducido por filósofos de la antigua Grecia, como Demócrito y Leucipo, pero tuvieron que pasar más de 2000 años para que estas teorías se convirtieran en una teoría atómica en el sentido moderno.
TEORÍA ATÓMICA DE DALTON:
La teoría atómica formulada por DALTON en 1803 y publicada en 1808, establece los siguientes postulados o hipótesis, partiendo de la idea de que la materia es discontinua;
- La materia se compone de partículas muy pequeñas denominadas átomos.
- Los átomos de un elemento son idénticos en todas sus propiedades.
- Los diferentes elementos están hechos de átomos distintos.
- Los átomos son indivisibles y conservan sus características en las reacciones químicas, en las que se combinan en proporciones numéricas simples.
A comienzos del siglo XIX se daba la siguiente situación en la ciencia:
- Dalton había determinado que la materia estaba formada por átomos indivisibles.
- Distintas experiencias demostraban que las partículas podían ganar o perder cargas eléctricas.
A continuación estudiaremos el descubrimiento de las distintas partículas que componen el átomo:
- En 1897 J.J. Thomson realizó experiencia en tubos de descarga y encontró que en los átomos de los elementos químicos existe una partícula con carga negativa a la que denominó electrón.
- En 1909, Robert Millikan determinó la carga del electrón: 1,6.10-19 C
- Como la materia es neutra, los átomos deben poseer además partículas con carga positiva del manera que todo átomo tenga tantas partículas positivas como negativas. Ernest Rutherford descubrió el protón, una partícula que tiene la misma carga que el electrón pero positiva y con una masa 1840 veces superior a la del electrón.
- Finalmente, James Chadwick en 1931, descubrió una tercera partícula sin carga eléctrica pero de masa similar al protón y la denominó neutrón.
- Hoy en día se sabe que el átomo tiene otras partículas más pequeñas de cuyo estudio se encarga la Física de la partícula, que no son objetivo de este curso pero que conviene saber que los protones y neutrones no son partículas elementales ya que están formados por quarks.
2. MODELOS ATÓMICOS:
A. Modelo de Thomson ("Pudin o pastel de pasas")
El átomo es una gran masa de carga positiva en la que se insertan los electrones. Debido a la repulsión entre los electrones, estos se distribuyen uniformemente en la esfera. La carga negativa de los electrones se compensa con la positiva para que el átomo sea neutro.
B. Modelo de Rutherford ("Planetario"):
- EXPERIENCIA DE LA LÁMINA DE ORO:
En el interior de un bloque de plomo se hizo una cavidad con una salida a. exterior en la que se colocó material radiactivo que producía los rayos alfa (recientemente Henri Becquerel había descubierto la radiactividad: emisión espontánea de partículas alfa emitidas por un mineral de uranio). Todos los rayos que no tuviesen la dirección del orificio de salida serían absorbidos por el plomo. Para conocer la trayectoria que seguían las partículas alfa después de chocar se rodeó esta con una película fotográfica. Se obtuvieron los siguientes resultados:
- La mayoría de las partículas alfa atravesaban la lámina de oro sin desviarse. (La mayor parte del átomo está vacío)
- Una pequeña proporción de partículas atravesaba la lámina, pero sufría una leve desviación. (Aquellas partículas que pasaban cerca del núcleo).
- Una de cada 10. 000 partículas alfa rebotaba al llegar a la lámina y volvía hacia atrás. (Una pequeñísima parte de las partículas chocaron con el núcleo).
Luego, debía existir en el átomo una zona con alta densidad de carga positiva, descubrió así el núcleo atómico.
(Notas: Las partículas alfa son núcleos de helio, por tanto, con carga positiva)
(Notas: Las partículas alfa son núcleos de helio, por tanto, con carga positiva)
- MODELO DE RUTHERFORD:
En el interior del átomo se encuentra un núcleo muy pequeño en comparación con el tamaño total del átomo, del orden de 10-14 m, en el que se concentra su carga positiva. Los electrones giran describiendo órbitas circulares alrededor del núcleo atómico como los planetas alrededor del Sol, debido a la atracción que sobre ellos ejercen las cargas positivas del núcleo. El radio de las órbitas es del mismo orden de magnitud que el átomo, 10-10 m
- Cuando un átomo pierde electrones, adquiere carga positiva y se convierte en ión positivo o catión.
- Cuando un átomo gana electrones, adquiere carga negativa y se convierte en ion negativo o anión.
Por tanto, el átomo es una estructura con un núcleo muy pequeño en relación al tamaño total del átomo. En el núcleo se encuentran los protones (Z) y neutrones (N). Alrededor del núcleo se mueven los electrones a una distancia muy grande a comparación con el tamaño de este. Es decir, la mayor parte del átomo está vacía.
Para representar un átomo se utiliza un símbolo con dos números: el número atómico, Z, que indica el número de protones y es el "DNI del átomo" y el número másico, A, indica su número de protones más el de neutrones.
- En un átomo neutro, el número de protones coincide con el número de electrones. Por tanto, Z también representa el número de electrones de un átomo neutro.
- Todos los átomos de un elemento químico tienen el mismo Z, es decir, todos tienen el mismo número de protones.
- Se llaman isótopos los átomos que tienen el mismo número de protones y se diferencian en el número de neutrones. Los isótopos son átomos del mismo elemento químico.
Ejemplo: Explica por qué son isótopos los átomos de potasio-39 y potasio-41
C. MODELO ATÓMICO DE BOHR
Niels Bohr realizó una serie de estudios y dedujo que el átomo está cuantizado: los electrones se organizan en niveles energéticos que tienen una capacidad limitada. Así, caben 2 electrones en el primer nivel (capa K, la más cercano al núcleo), 8 en el segundo (L), 18 en el tercero (M) y en el cuarto nivel de energía puede haber hasta 32 electrones,...
Los electrones se colocan en el átomo ocupando el nivel de menor energía que esté libre. Si un átomo o ion tiene un solo electrón, este se situará en el primer nivel de energía,el más cercano al núcleo.
Para calcular el número de electrones en cada nivel: 2n2
En el modelo de Bohr, los electrones solo se pueden encontrar girando en determinados niveles de energía (órbitas permitidas) pero sin radiar o emitir energía electromagnética. La emisión de energía se produce cuando un electrón de un nivel energético superior cambia su movimiento para moverse en una órbita de menor energía.
PARA REPASAR: Aquí tenéis dos resúmenes de los Modelos atómicos I y II
VÍDEO:
PARA REPASAR: Aquí tenéis dos resúmenes de los Modelos atómicos I y II
VÍDEO:
ACTIVIDADES de repaso para 4º ESO:
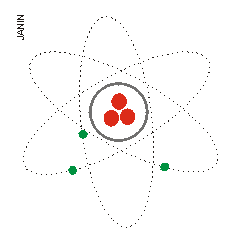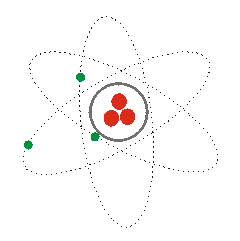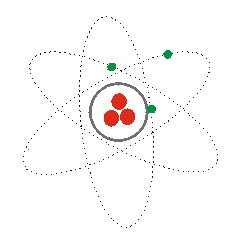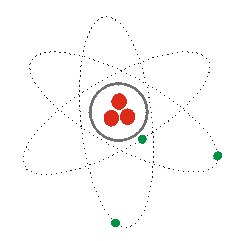
1) Según lo visto, ¿a qué modelos se refieren las siguientes imágenes? Explícalos.
3) ¿De qué nos informa la siguiente notación referida a un elemento químico?
1) Según lo visto, ¿a qué modelos se refieren las siguientes imágenes? Explícalos.
(1) (2) (3)
2) ¿En qué consistió la experiencia de Rutherford de la lámina de oro? ¿Por qué fue tan crucial e importante?
3) ¿De qué nos informa la siguiente notación referida a un elemento químico?
(Error: 2-)
4) ¿Qué es un isótopo? Representa y explica:
a) el conjunto de isótopos del hidrógeno (hidrógeno-1, hidrógeno-2 e hidrógeno-3).
b) los átomos isótopos del carbono: C-12, C-13 y C-14.
Datos: Hidrógeno Z = 1; Carbono Z = 6
a) el conjunto de isótopos del hidrógeno (hidrógeno-1, hidrógeno-2 e hidrógeno-3).
b) los átomos isótopos del carbono: C-12, C-13 y C-14.
Datos: Hidrógeno Z = 1; Carbono Z = 6
Solución
5) ¿Qué son los iones? ¿Qué dos tipos hay? Pon ejemplos.
5) ¿Qué son los iones? ¿Qué dos tipos hay? Pon ejemplos.
D. MODELO ATÓMICO ACTUAL: MODELO MECANO-CUÁNTICO (Schrödinger).
El modelo de Bohr tampoco es suficientemente preciso para indicar donde se encuentra cada electrón de un átomo, ya que existen también subniveles energéticos.
El modelo mecano-cuántico establece que los electrones se encuentran alrededor del núcleo ocupando posiciones más o menos probables, pero su posición no se puede predecir con total exactitud (recuerda que, por el contrario, en el modelo de Bohr se suponía que los electrones se encontraban en posiciones concretas a unas distancias definidas del núcleo).
Se denomina orbital a la región del espacio en la que existe una probabilidad elevada (superior al 90%) de encontrar un electrón. No es lo mismo órbita (Bohr) que orbital.
TIPOS de orbitales:
Los estudios de Schrödinger demostraron que existen distintos tipos de orbitales que se identifican con las letras: s, p, d y f. La forma y el tamaño de un orbital dependen del nivel y del subnivel de energía en que se encuentran, así:
- Los orbitales s tienen forma esférica alrededor del núcleo. Siendo el 2s (el orbital s del nivel 2) de mayor tamaño que el orbital 1s, y el 3s mayor que los anteriores.
- Los orbitales p forma de lóbulos o de ocho "8".
CONFIGURACIONES ELECTRÓNICAS:
En el siguiente diagrama (DIAGRAMA DE MOELLER) se relacionan los orbitales que hay en cada nivel. Además, te ayudará para realizar la configuración electrónica de un átomo (principio de construcción o de Aufbau).
Se denomina configuración electrónica de un átomo al modo en que están distribuidos los electrones alrededor del núcleo de ese átomo. Reglas:
- En cada orbital solo puede haber dos electrones, pero en distinto estado cuántico (Principio de exclusión de Pauli). Ej: Berilio.
- Los electrones se van colocando en el átomo ocupando el orbital de menor energía que esté vacante (Principio de prioridad de los estados de mínima energía).
- Se colocan primero los electrones que estén girando en el mismo sentido de modo que haya el máximo posible de electrones desapareados (Regla de Hund o de máxima multiplicidad) Ej: Nitrógeno.
Se denomina electrón de valencia a los electrones responsables del comportamiento químico de los átomos. Son los electrones situados en el último nivel. En el caso del litio, la capa de valencia es la 2, en ella hay 1 electrón de valencia. En el caso del azufre es la 3, en ella hay 6 electrones de valencia: 3s2 3p4. Los gases nobles tienen su último nivel completo, no caben en él más electrones.
La valencia de un elemento es el número de electrones que necesita o que le sobra para tener completo su último nivel. Por tanto, la valencia de los gases nobles es cero. En el caso del sodio la valencia es 1, si pierde un electrón se queda con su último nivel completo.
VIDEO: Puedes ver como se realiza la configuración electrónica
VIDEO: Puedes ver como se realiza la configuración electrónica
EL SISTEMA PERIÓDICO.
En la tabla se representan todos los elementos químicos que se conocen hasta hoy. Esta organización se denomina sistema periódico y en ella se recogen todos los elementos químicos en orden creciente de número atómico (Z).
Existen 7 períodos (filas horizontales) y 18 grupos (columnas verticales). La colocación de un elemento en una casilla concreta depende de su configuración electrónica.
En la tabla se representan todos los elementos químicos que se conocen hasta hoy. Esta organización se denomina sistema periódico y en ella se recogen todos los elementos químicos en orden creciente de número atómico (Z).
Existen 7 períodos (filas horizontales) y 18 grupos (columnas verticales). La colocación de un elemento en una casilla concreta depende de su configuración electrónica.
GRUPOS:
- Metales (a la izquierda de la tabla)
a) Los átomos del grupo 1, los alcalinos, tienen 1 electrón en el último nivel. Configuración ns1. Deben perder un electrón para conseguir la configuración más estable, se convierten en cationes con carga +1.
b) Los átomos del grupo 2 se denominan alcalinotérreos, su configuración es del tipo ns2 y se convierten en un catión con carga +2.
- Metales (a la izquierda de la tabla)
a) Los átomos del grupo 1, los alcalinos, tienen 1 electrón en el último nivel. Configuración ns1. Deben perder un electrón para conseguir la configuración más estable, se convierten en cationes con carga +1.
b) Los átomos del grupo 2 se denominan alcalinotérreos, su configuración es del tipo ns2 y se convierten en un catión con carga +2.
c) Del grupo 3 al 12 se denominan metales de transición. Entre ellos se encuentran elementos que reconocemos como metales en su estado natural, como el oro, el hierro, la plata, el cobre, etc. Su configuración electrónica es del tipo d. No obstante, sus electrones de valencia y la capa de valencia es la mayor que sale al realizar su configuración electrónica.
d) Grupo 13: Boroideos. Tienen 3 electrones en el último nivel, tienden a convertirse en iones +3. Entre el boro y el aluminio comienza la línea divisoria entre metales y no metales. Es decir, son todos metales excepto el Boro.
- No metales (a la derecha de la tabla).
e) Grupo 14: Carbonoideos. Su configuración electrónica es del tipo ns2 np2, pueden o perder 4 electrones o ganarlos para adquirir el mismo número de electrones que un gas noble.
f) Grupo 15: Nitrogenoideos. Carga -3 pues les faltan tres electrones para conseguir una configuración estable. (ns2 np3)
g) Grupo 16: Anfígenos. Carga -2. (ns2 np4) Todos son no metales excepto el polonio.
h) Grupo 17: Halógenos. Carga -1. 7 electrones en el último nivel (ns2 np5). Todos son no metales.
- Grupo 18: Gases nobles. Tienen completo su último nivel, ocho electrones (ns2 np6) salvo en el caso del helio (2s2). No ganan ni pierden electrones por lo que son los elementos más estables de la tabla periódica.
- Bloque f: Lantánidos y Actínidos. Son los elementos de transición interna por tener sus electrones de valencia en el orbital f.
a) Lantánidos o lantanoides (de Z = 57, lantano, a Z = 71), también conocidos como tierras raras (aparecen en forma de óxidos) aunque se suelen representar a parte, en un versión ampliada de la tabla periódica puedes observar que forman parte del periodo 6.
b) Actínidos o actinoides (de Z = 89, actinio, a Z = 103 ) forman parte del periodo 7 de la tabla periodica. Los de mayor número atómico no se encuentran en la naturaleza y tienen tiempos de vida media muy corto; todos sus isótopos son radiactivos.
Características de un elemento de la tabla periódica:
En cada elemento se representa, como mínimo, el símbolo del mismo, su nombre, el número atómico y su masa atómica expresada en u. Aunque también podría aparecer alusiones a la configuración electrónica y propiedades tales como densidad y puntos de fusión y ebullición.
Siendo siempre bien visible el símbolo y su número atómico.
PARA SABER MÁS: El origen mitológico del nombre del elemento químico.
LAS PROPIEDADES PERIÓDICAS.
Como hemos visto, en el S.P. los elementos están organizados en orden creciente de número atómico (Z). El periodo coincide con la capa de valencia y el grupo con los últimos electrones de dicha capa. Podemos establecer relaciones entre las propiedades químicas y la posición de los elementos en la tabla periódica.
Se llaman propiedades periódicas de los elementos químicos a las propiedades que podemos estudiar en relación con la posición del elemento en el sistema periódico.
1. El tamaño de los átomos: el radio atómico.
 Aunque carece de sentido físico, se acepta por convenio que el radio atómico es la mitad de la distancia internuclear entre dos átomos de un mismo elemento unidos por enlace químico.
Aunque carece de sentido físico, se acepta por convenio que el radio atómico es la mitad de la distancia internuclear entre dos átomos de un mismo elemento unidos por enlace químico.
A lo largo de un período, el número de capas no aumenta pero sí el número atómico (protones en el núcleo) por lo que la nube electrónica se contrae hacia el núcleo y el radio disminiuye. Así, los alcalinos tienen mayores radios atómicos que los gases nobles.
En un grupo, el radio atómico crece hacia abajo ya que los electrones se van situando en niveles energéticos "más alejados" del núcleo.
d) Grupo 13: Boroideos. Tienen 3 electrones en el último nivel, tienden a convertirse en iones +3. Entre el boro y el aluminio comienza la línea divisoria entre metales y no metales. Es decir, son todos metales excepto el Boro.
- No metales (a la derecha de la tabla).
e) Grupo 14: Carbonoideos. Su configuración electrónica es del tipo ns2 np2, pueden o perder 4 electrones o ganarlos para adquirir el mismo número de electrones que un gas noble.
f) Grupo 15: Nitrogenoideos. Carga -3 pues les faltan tres electrones para conseguir una configuración estable. (ns2 np3)
g) Grupo 16: Anfígenos. Carga -2. (ns2 np4) Todos son no metales excepto el polonio.
h) Grupo 17: Halógenos. Carga -1. 7 electrones en el último nivel (ns2 np5). Todos son no metales.
- Grupo 18: Gases nobles. Tienen completo su último nivel, ocho electrones (ns2 np6) salvo en el caso del helio (2s2). No ganan ni pierden electrones por lo que son los elementos más estables de la tabla periódica.
- Bloque f: Lantánidos y Actínidos. Son los elementos de transición interna por tener sus electrones de valencia en el orbital f.
a) Lantánidos o lantanoides (de Z = 57, lantano, a Z = 71), también conocidos como tierras raras (aparecen en forma de óxidos) aunque se suelen representar a parte, en un versión ampliada de la tabla periódica puedes observar que forman parte del periodo 6.
b) Actínidos o actinoides (de Z = 89, actinio, a Z = 103 ) forman parte del periodo 7 de la tabla periodica. Los de mayor número atómico no se encuentran en la naturaleza y tienen tiempos de vida media muy corto; todos sus isótopos son radiactivos.
Características de un elemento de la tabla periódica:
En cada elemento se representa, como mínimo, el símbolo del mismo, su nombre, el número atómico y su masa atómica expresada en u. Aunque también podría aparecer alusiones a la configuración electrónica y propiedades tales como densidad y puntos de fusión y ebullición.
Siendo siempre bien visible el símbolo y su número atómico.
PARA SABER MÁS: El origen mitológico del nombre del elemento químico.
LAS PROPIEDADES PERIÓDICAS.
Como hemos visto, en el S.P. los elementos están organizados en orden creciente de número atómico (Z). El periodo coincide con la capa de valencia y el grupo con los últimos electrones de dicha capa. Podemos establecer relaciones entre las propiedades químicas y la posición de los elementos en la tabla periódica.
Se llaman propiedades periódicas de los elementos químicos a las propiedades que podemos estudiar en relación con la posición del elemento en el sistema periódico.
1. El tamaño de los átomos: el radio atómico.
 Aunque carece de sentido físico, se acepta por convenio que el radio atómico es la mitad de la distancia internuclear entre dos átomos de un mismo elemento unidos por enlace químico.
Aunque carece de sentido físico, se acepta por convenio que el radio atómico es la mitad de la distancia internuclear entre dos átomos de un mismo elemento unidos por enlace químico.A lo largo de un período, el número de capas no aumenta pero sí el número atómico (protones en el núcleo) por lo que la nube electrónica se contrae hacia el núcleo y el radio disminiuye. Así, los alcalinos tienen mayores radios atómicos que los gases nobles.
En un grupo, el radio atómico crece hacia abajo ya que los electrones se van situando en niveles energéticos "más alejados" del núcleo.
Se habla también de radio iónico, en referencia al tamaño que tiene un ion, mayor o menor, respecto del átomo neutro.
ACTIVIDADES:
1. Ordena razonadamente de mayor a menor (orden decreciente) según su tamaño los siguientes elementos químicos: O. Kr, Ba, H, Cs, B, C, F, Rn, He
2. Razona si los siguientes iones son mayores que el elemento neutro: catión calcio, anión cloruro, anion bromuro, catión aluminio, O2-, H+, catión litio, cation berilio.
2. Energía de ionización.
Es la energía que se debe aplicar a un átomo en su estado fundamental para extraer su electrón más débilmente ligado, es decir, de su última capa. Es un proceso endotérmico (que requiere energía) que se suele representar así:
X + Energía Ionización - X+ + electrón.
Esta energía se mide en electrón -voltios (eV) para un átomo aislado y en KJ para un mol de átomos.
Variación:
- Disminuye al bajar en un grupo pues aumenta el número de capas electrónicas y el apantallamiento del núcleo por lo que es más fácil extraer el electrón, hay que suministrar menor energía.
- Al aumentar el número atómico dentro de un período, esta energía aumenta porque aumenta el número de protones en el núcleo sin que aumente el número de capas.
3. Afinidad electrónica.
Es el fenómeno opuesto al anterior. Consiste en la energía desprendida cuando un átomo capta un electrón para convertirse en anión.
X + e- - X- + Eafinidad electronica.
Es un proceso generalmente exotérmico, especialmente en los elementos que tienen más interés que son los no metales.
Dentro de un grupo, la afinidad electrónica, disminuye conforme se desciende en el mismo por razón del mayor apantallamiento que proporcionan las capas en número creciente.
En un período, aumenta ya que aumenta la carga del núcleo y la atracció n hacia el nuevo electrón.
4. Electronegatividad.
Es un índice que informa sobre la tendencia de un átomo a apropiarse de una pareja de electrones que comparte con otro. Aumenta hacia la derecha de un período y hacia arriba de un grupo, siendo los halógenos y el oxígeno los elementos más electronegativos. A mayor diferencia entre las electronegatividades de dos átomos enlazados es un indicador del carácter iónico del enlace.
5. Carácter metálico-no metálico.
Como comentamos, se llaman metales a los elementos que tienen a perder electrones para alcanzar la configuración de gas noble y no metales a los que tienen a ganarlos. Los metales se convertirán en iones positivos o cationes y los no metales en iones negativos o aniones.
Según lo visto, ¿cómo explicarías la diferencia entre radio iónico y el del átomo neutro?
A continuación se resume la variación de las propiedades periódicas:
ACTIVIDADES:
1. Ordena razonadamente de mayor a menor (orden decreciente) según su tamaño los siguientes elementos químicos: O. Kr, Ba, H, Cs, B, C, F, Rn, He
2. Razona si los siguientes iones son mayores que el elemento neutro: catión calcio, anión cloruro, anion bromuro, catión aluminio, O2-, H+, catión litio, cation berilio.
2. Energía de ionización.
Es la energía que se debe aplicar a un átomo en su estado fundamental para extraer su electrón más débilmente ligado, es decir, de su última capa. Es un proceso endotérmico (que requiere energía) que se suele representar así:
X + Energía Ionización - X+ + electrón.
Esta energía se mide en electrón -voltios (eV) para un átomo aislado y en KJ para un mol de átomos.
Variación:
- Disminuye al bajar en un grupo pues aumenta el número de capas electrónicas y el apantallamiento del núcleo por lo que es más fácil extraer el electrón, hay que suministrar menor energía.
- Al aumentar el número atómico dentro de un período, esta energía aumenta porque aumenta el número de protones en el núcleo sin que aumente el número de capas.
3. Afinidad electrónica.
Es el fenómeno opuesto al anterior. Consiste en la energía desprendida cuando un átomo capta un electrón para convertirse en anión.
X + e- - X- + Eafinidad electronica.
Es un proceso generalmente exotérmico, especialmente en los elementos que tienen más interés que son los no metales.
Dentro de un grupo, la afinidad electrónica, disminuye conforme se desciende en el mismo por razón del mayor apantallamiento que proporcionan las capas en número creciente.
En un período, aumenta ya que aumenta la carga del núcleo y la atracció n hacia el nuevo electrón.
4. Electronegatividad.
Es un índice que informa sobre la tendencia de un átomo a apropiarse de una pareja de electrones que comparte con otro. Aumenta hacia la derecha de un período y hacia arriba de un grupo, siendo los halógenos y el oxígeno los elementos más electronegativos. A mayor diferencia entre las electronegatividades de dos átomos enlazados es un indicador del carácter iónico del enlace.
5. Carácter metálico-no metálico.
Como comentamos, se llaman metales a los elementos que tienen a perder electrones para alcanzar la configuración de gas noble y no metales a los que tienen a ganarlos. Los metales se convertirán en iones positivos o cationes y los no metales en iones negativos o aniones.
Según lo visto, ¿cómo explicarías la diferencia entre radio iónico y el del átomo neutro?
A continuación se resume la variación de las propiedades periódicas:
ACTIVIDADES
1. Realiza una tabla en la que indiques A, Z, número de protones, electrones y neutrones de los isótopos del carbono (carbono-12, carbono-13 y carbono-14).
2. Escribe la configuración electrónica de los siguientes átomos e iones: 73Li, 2311Na, 3913K, 2010Ne, 199F-1,2412Mg2+, 2713Al3+
3. Realiza una tabla en la que indiques el número atómico, la configuración electrónica, la capa de valencia y el número electrones de valencia de los siguientes elementos: Fósforo, Cloro, Calcio, Oxígeno, Estaño, Aluminio, Xenón y Rubidio.
4. Realiza una tabla en la que indiques el átomo, los protones, los electrones, la configuración electrónica, el grupo, la familia, el período y el carácter metálico de los siguientes elementos: Ne, F, O, I, Be, B y Fe.
5. Indica el elemento de mayor carácter metálico de cada pareja: a) Sodio y cesio; b) Cesio y plomo.
6. Indica el elemento de mayor carácter no metálico: a) Flúor y yodo; b) Nitrógeno y flúor.
EL ENLACE QUÍMICO.
Se denomina enlace químico entre átomos la unión que mantiene unidos a los átomos debido a las fuerzas de atracción existentes entre ellos, fuerza de naturaleza eléctrica.
Existen tres tipos de enlace químico: enlace iónico, enlace covalente y enlace metálico.
ACTIVIDAD: Copia en el cuaderno la siguiente gráfica y cométala. ¿Qué relación guarda con la definición de enlace químico?
1. Realiza una tabla en la que indiques A, Z, número de protones, electrones y neutrones de los isótopos del carbono (carbono-12, carbono-13 y carbono-14).
2. Escribe la configuración electrónica de los siguientes átomos e iones: 73Li, 2311Na, 3913K, 2010Ne, 199F-1,2412Mg2+, 2713Al3+
3. Realiza una tabla en la que indiques el número atómico, la configuración electrónica, la capa de valencia y el número electrones de valencia de los siguientes elementos: Fósforo, Cloro, Calcio, Oxígeno, Estaño, Aluminio, Xenón y Rubidio.
4. Realiza una tabla en la que indiques el átomo, los protones, los electrones, la configuración electrónica, el grupo, la familia, el período y el carácter metálico de los siguientes elementos: Ne, F, O, I, Be, B y Fe.
5. Indica el elemento de mayor carácter metálico de cada pareja: a) Sodio y cesio; b) Cesio y plomo.
6. Indica el elemento de mayor carácter no metálico: a) Flúor y yodo; b) Nitrógeno y flúor.
EL ENLACE QUÍMICO.
Se denomina enlace químico entre átomos la unión que mantiene unidos a los átomos debido a las fuerzas de atracción existentes entre ellos, fuerza de naturaleza eléctrica.
Existen tres tipos de enlace químico: enlace iónico, enlace covalente y enlace metálico.
ACTIVIDAD: Copia en el cuaderno la siguiente gráfica y cométala. ¿Qué relación guarda con la definición de enlace químico?
RESPUESTA:
La gráfica anterior responde a la pregunta por qué se unen los átomos:
La gráfica anterior responde a la pregunta por qué se unen los átomos:
Los átomos se unen entre sí porque así llegan a una situación de mínima energía, lo que equivale a decir de máxima estabilidad. Son los electrones más externos (electrones de valencia) los responsables de esta unión, al igual que de la estequiometría y la geometría de las sustancias químicas.
Distinguimos varias zonas en la gráfica a comentar:
1 a 3 representa el acercamiento entre átomos. Conformo se acercan la energía disminuye hasta llegar a 4
3. Distancia de máxima estabilidad.
4. En adelante, si continuaran el acercamiento, la energía volvería a subir debida a la repulsión entre núcleos + +
1. ENLACE IÓNICO
El enlace iónico se produce cuando se combinan un metal y un no metal. El metal alcanza la configuración electrónica del gas noble cediendo electrones (convirtiéndose en un catión). El no metal capta los electrones (convirtiéndose en anión). Es decir: el enlace iónico se da entre iones de signos distintos, ya que las cargas de distinto signo se atraen:
Se cumple la regla del octeto que Lewis propuso en 1923: dos átomos tienden a alcanzar ocho electrones en su capa de valencia; para ello se enlazan a otros átomos ganando/perdiendo (e.iónico) electrones o compartiéndolos (e. covalente).
En un compuesto iónico la fórmula solo indica la proporción en las que se encuentran los átomos (1:1, 1:2). En el enlace iónico no se forman moléculas aisladas. Los compuestos iónicos son sólidos cristalinos (una red cristalina es una estructura tridimensional constituida por un número enorme de iones de distinto signo). En resumen, el enlace iónico es fuerte y sus sustancias así formadas son sólidas a temperatura ambiente y tienen puntos de fusión y ebullición elevados.
ACTIVIDAD: Explica, según lo visto y razonadamente, la formación del óxido de calcio.
FORMACIÓN DEL CLORURO DE SODIO (NaCl)
2. ENLACE COVALENTE
El enlace covalente se produce cuando se combinan dos no metales. Los no metales necesitan captar electrones para alcanzar la configuración de gas noble y el único modo de conseguirlo es compartiendo pares de electrones.
Por tanto, el enlace covalente se da entre átomos que comparten electrones. Estos electrones son atraídos por los núcleos de los dos átomos.
Estructuras de Lewis: Lewis propuso representar los enlaces usando los símbolos de los elementos y puntos (.) para los electrones de valencia -o aspas (x) para distinguir si hay electrones de otro elemento-. El par de electrones compartido se representa mediante una raya entre los átomos. Las moléculas así formadas cumplen la regla del octeto electrónico.
Ejemplos:
Distinguimos entre enlace covalente apolar y polar:
- En el enlace covalente apolar se unen átomos del mismo elemento químico. Por tanto, los electrones de valencia se comparten equitativamente ya que los elementos que se unen tienen la misma electronegatividad. Se forman elementos moleculares como por ejemplo: H-H, O=O, Cl-Cl, etc.
- En el enlace covalente polar se unen átomos de elementos distintos, con distintas electronegatividades y, por tanto, los electrones se comparten de forma desigual. Los electrones se orientan hacia el átomo más electronegativo formándose polos en las moléculas detectándose diferencias de cargas o densidades eléctricas pequeñas y parciales: se detecta una densidad de carga positiva (pequeña y parcial) y una densidad de carga negativa en el elemento más electronegativo. Ejemplos: H→Cl, H2O,
La polaridad de la mólecula de agua es la responsable de la estructura de la molécula de agua (ángulo de 104,5º entre hidrógenos) y de sus propiedades físicoquimicas e importancia biológica: formación de puentes de hidrógeno, "disolvente universal", tensión superficial, etc.
ACTIVIDAD: Explica la formación de la molécula de nitrógeno (dinitrógeno) y del metano utilizando las estructuras de Lewis.
3. ENLACE METÁLICO
El enlace metálico se produce cuando se combinan metales entre sí.
Los átomos de metales necesitan ceder electrones para alcanzar la configuración de gas noble. En este caso, los metales ceden los electrones de valencia y se forma una nube electrónica entre los núcleos positivos. El enlace metálico se debe a la atracción entre los electrones de valencia de todos los átomos y los iones positivos que se forman.
Es el enlace propio entre los metales como el oro, la plata, el estaño, el mercurio, etc.
Gracias a la movilidad de los electrones se explican propiedades como la alta conductividad eléctrica y térmica de los metales. La nube electrónica actúa como "pegamento" entre los cationes, son estructuras muy compactas por eso los metales son casi todos sólidos a temperatura ambiente y tienen elevados puntos de fusión y ebullición.
SUSTANCIAS QUE SURGEN DE LOS DISTINTOS TIPOS DE ENLACE Y SUS PROPIEDADES.
A. Átomos aislados: gases nobles.
B. Sustancias moleculares: Una molécula es un conjunto de átomos unidos mediante enlace covalente. Si no existen fuerzas entre las moléculas suelen ser gases a temperatura ambiente (H2, O2, N2,...). Si existen fuerzas entre unas moléculas y otras, pueden aparecer en estado líquido, aunque son interacciones más débiles que el enlace químico, por ejemplo, en el agua debido a su carácter polar se forman enlaces o puentes de hidrógenos entre sus moléculas.
Propiedades: En general, suelen ser sustancias gaseosas, suelen presentar bajos puntos de fusión y ebullición. No conducen la corriente eléctrica y, si son sólidas, son blandas y quebradizas. No se disuelven en agua.
C. Cristales: Tenemos un cristal cuando las partículas que forman la materia tienen una estructura perfectamente ordenada. que se extiende en las tres direcciones del espacio. Son sólidos. Distinguimos:
c1) Cristal iónico: si las partículas que forman el cristal son iones. Ej: NaCl
c2) Cristal covalente: si las partículas que forman el cristal son átomos. Ej: SiO2 (sílice, la materia prima que forma la arena de la playa), el grafito, el diamante, ...
c3) Cristal metálico: si las partículas que forman el cristal son iones positivos inmersos en un "mar" de electrones. Ej: Pt
Propiedades:
c1) Los cristales iónicos no forman moléculas. Son sólidos a temperatura ambiente con altos puntos de fusión y ebullición . Son solubles en agua y solo conducen la corriente eléctrica fundidos o disueltos. Son duros y frágiles, ya que un pequeño golpe hará que se desplacen los iones y queden enfrentados iones del mismo signo, la repulsión hará que se rompa el cristal.
c2) Cristales covalentes: En general, son muy duros, tienen elevados puntos de fusión y ebullición. No conducen la corriente eléctrica porque no tienen electrones o iones "libres" que puedan moverse. Un caso curioso es el del grafito y el diamante, ambos están formados por átomos de carbono, su composición química es igual pero su estructura interna es diferente dando lugar a brillos y durezas muy distintas.
c3) Cristales metálicos: Tienen un brillo característico. Son muy buenos conductores de la electricidad y del calor. No son solubles en agua. Son duros, pero se pueden separar en láminas (dúctiles) o hilos (maleables) y se pueden rayar. A diferencia de los cristales iónicos un golpe en la estructura no la rompe, solo se desplaza ya que la nube de electrones sigue manteniéndola unida.
ACTIVIDAD: Realiza en el cuaderno una tabla que resuma las propiedades según los enlaces vistos. (puntos de fusión y ebullición, dureza, solubilidad, conductividad térmica, conductividad eléctrica, etc).
ACTIVIDADES
1. Indica razonadamente el tipo de enlace existente en las siguientes sustancias e indica si son elementos o compuestos: BeI2 , CCl4, Cu, NaCl, CO2, He, hierro, yoduro de sodio, oxígeno, dióxido de azufre, agua, cloro, fluoruro de magnesio y amoníaco.
2.Según el tipo de enlace señala las propiedades esperadas en las sustancias formadas en la actividad anterior.














.png)










