Páginas
▼
jueves, 22 de diciembre de 2022
miércoles, 14 de diciembre de 2022
martes, 25 de octubre de 2022
Modelos atómicos en imágenes y enlaces
La palabra átomo proviene del griego y significa indivisible. El concepto fue introducido por filósofos de la antigua Grecia, como Demócrito y Leucipo, pero tuvieron que pasar más de 2000 años para que estas teorías se convirtieran en una teoría atómica en el sentido moderno
La teoría atómica formulada por DALTON en 1803 y publicada en 1808, establece los siguientes postulados o hipótesis, partiendo de la idea de que la materia es discontinua;
- La materia se compone de partículas muy pequeñas inseparables denominadas átomos.
- Los átomos de un elemento son idénticos en todas sus propiedades.
- Los diferentes elementos están hechos de átomos distintos.
- Los átomos son indivisibles y conservan sus características en las reacciones químicas, en las que se combinan en proporciones numéricas simples.
A comienzos del siglo XIX se daba la siguiente situación en la ciencia:
- Dalton había determinado que la materia estaba formada por átomos indivisibles.
- Distintas experiencias demostraban que las partículas podían ganar o perder cargas eléctricas (electrización).
A. MODELO DE THOMSON ("pastel de pasas").
El átomo es una gran masa de carga positiva en la que se insertan los electrones. Debido a la repulsión entre los electrones, estos se distribuyen uniformemente en la esfera. La carga negativa de los electrones se compensa con la positiva para que el átomo sea neutro.
B. MODELO DE RUTHERFORD:
- Núcleo: muy pequeño en el que se concentra la masa del átomo y su carga positiva.
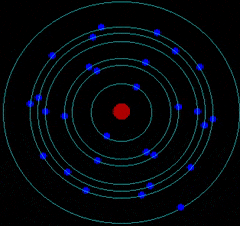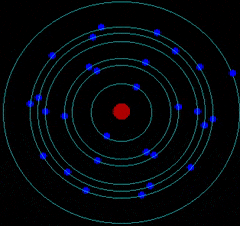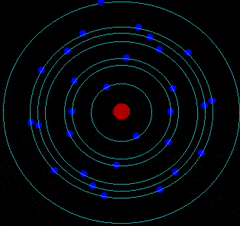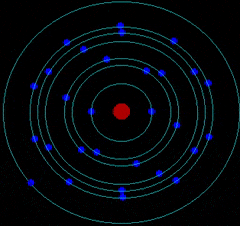
- Corteza: donde los electrones giran describiendo órbitas circulares alrededor del núcleo atómico como los planetas alrededor del Sol.
Por tanto, el átomo es una estructura con un núcleo muy pequeño en relación al tamaño total del átomo. En el núcleo se encuentran los protones (Z) y neutrones (N). Alrededor del núcleo se mueven los electrones a una distancia muy grande a comparación con el tamaño de este. Es decir, la mayor parte del átomo está vacía.
Con este modelo se pueden explicar los iones:
- Cuando un átomo pierde electrones, adquiere carga positiva y se convierte en ión positivo o catión.
- Cuando un átomo gana electrones, adquiere carga negativa y se convierte en ion negativo o anión.
Para representar un átomo se utiliza un símbolo con dos números: el número atómico, Z, que indica el número de protones y es el "DNI del átomo" y el número másico, A, indica su número de protones más el de neutrones.
- En un átomo neutro, el número de protones coincide con el número de electrones. Por tanto, Z también representa el número de electrones de un átomo neutro.
- Todos los átomos de un elemento químico tienen el mismo Z, es decir, todos tienen el mismo número de protones.
- Se llaman isótopos los átomos que tienen el mismo número de protones y se diferencian en el número de neutrones. Los isótopos son átomos del mismo elemento químico.
Ejemplo: Explica por qué son isótopos los átomos de potasio-39 y potasio-41
C. MODELO ATÓMICO DE BOHR
Niels Bohr realizó una serie de estudios y dedujo que el átomo está cuantizado: Los electrones se colocan en el átomo ocupando niveles de meenergía
Los electrones solo se pueden encontrar girando en determinados niveles de energía (órbitas permitidas) pero sin radiar o emitir energía electromagnética.
PARA REPASAR: Aquí tenéis dos resúmenes de los modelos atómicos (click -> II)
VÍDEOS:
D. MODELO ATÓMICO ACTUAL: MODELO MECANO-CUÁNTICO (Schrödinger).
El modelo mecano-cuántico establece que los electrones se encuentran alrededor del núcleo ocupando posiciones más o menos probables, pero su posición no se puede predecir con total exactitud (recuerda que, por el contrario, en el modelo de Bohr se suponía que los electrones se encontraban en posiciones concretas a unas distancias definidas del núcleo).
Se denomina orbital a la región del espacio en la que existe una probabilidad elevada (superior al 90%) de encontrar un electrón. No es lo mismo órbita (Bohr) que orbital.
Ideas claras
jueves, 22 de septiembre de 2022
La composición de los seres vivos
SESIÓN
1: “Nuestro planeta presenta una gran diversidad”
RESPUESTA: La vida en la Tierra
-
ACTIVIDADES
1) ¿Qué es la
biodiversidad?
2) Explica por qué un gato
es un ser vivo y un peluche no lo es.
Actividad interactiva tipos de alimentación:
3) Resume las semejanzas y
diferencias existentes entre la nutrición autótrofa y heterótrofa. Pon
ejemplos.
4) Explica las diferencias
entre la reproducción sexual y asexual.
¿Qué son los gametos?
“Todos
los seres vivos tenemos en común que estamos formados por células”
PREGUNTA:
¿Con qué instrumento podemos adentrarnos en el mundo de lo que no se ve simple
vista?
ACTIVIDADES:
1. Define célula.
2. ¿Qué tipos de células
hay?
3. Haz una tabla como la de
la página 49 (ejercicio 6) en la que diferencies entre los tipos de células.
VAMOS A REPASAR LO QUE HEMOS VISTO: LA CELULA
SESIÓN 5:
PREGUNTAS: ¿Qué son los orgánulos?
RESPUESTA: Aquí
.
4. ¿Qué es la teoría
celular? ¿Qué dice?
5. LA CÉLULA EUCARIOTA ANIMAL: Construye tu propia célula. Debes de destacar los distintos orgánulos. Se trata de una actividad que puntúa como el informe de prácticas. Dibujar en cartulina una célula. La entrega tiene que ser ANTES DE DOS SEMANAS.
SESIÓN 6:
“Los
organismos pluricelulares estamos formados por más de una célula”
Actividad
interactiva: niveles de complejidad
ACTIVIDADES:
1. Resumen de los niveles
de complejidad de la pág. 50 del libro.
2. ¿En cuál nivel te
encuadrarías?
SESION 7, 8 y 9:
“La ciencia que se encarga de clasificar los seres vivos
se llama TAXONOMÍA”
Lectura Pag.52
· Presentaciones:
-
PREGUNTA: ¿Cuántos reinos existen en la naturaleza?
RESPUESTA: Los ¿? reinos
Para saber más sobre los reinos
· Actividad interactiva:
Comparando taxones ...
SESION 10:
“La organización y el trabajo en equipo siempre facilita
las cosas”
· Vamos a agrupar los siguientes seres vivos en REINOS
-
Formemos 6 grupos:
Cada
grupo se encargará de los siguientes REINOS
Grupo
1: Reino moneras y reino protoctistas.
Grupo
2: Reino hongos y reino plantas.
Grupo
3: Reino animal – Invertebrados 1 (poríferos, gusanos, artrópodos)
Grupo
4: Reino animal – Invertebrados 2 (cnidarios, moluscos, equinodermos)
Grupo 5: Reino animal – Filo cordados
(vertebrados 1): Peces, anfibios, reptiles.
Grupo
6: Reino animal – Filo cordados (vertebrados 2): Aves, mamíferos.
Clasificando los seres vivos en su correspondiente “taxón”
SESIÓN 11 ¿Por qué hay vida en la Tierra?
Lectura: ¿Por
qué hay vida en la Tierra?
Trabajaremos
la lectura de la pág 54 y
realizaremos las actividades propuestas.
SESIÓN
12:
ACTIVIDADES DE CIERRE DE TEMA:
·
PAG. 55: Copia y completa mapa conceptual, PON EJEMPLOS en
cada nivel de organización.
·
Investiga con tu portátil y encuentra definiciones para:
FUNCIÓN NUTRICIÓN, FUNCIÓN RELACIÓN y FUNCIÓN REPRODUCCIÓN.
·
DEFINE:
-
Nutrición autótrofa
-
Nutrición heterótrofa
-
Gameto
-
Célula
-
Procariota
-
Eucariota
-
Colonia
-
Taxón
-
Especie
VIDEOS RELACIONADOS CON LA CÉLULA
* ENFERMEDADES CAUSADAS POR BACTERIAS (PROCARIOTAS)
* LA MITOSIS CELULAR PROCARIOTAS)
jueves, 15 de septiembre de 2022
¿Para qué sirve la química?
Avec le concept Smart Chemistry Smart Future, nous avons pu voir la contribution des différentes entreprises chimiques à la société.
L'industrie chimique apporte des solutions pour réduire les émissions de gaz à effet de serre.