TEMA 5 y 6: LAS REACCIONES QUÍMICAS.
5.1. ¿Qué es una reacción química?
- Teoría de las colisiones y teoría del estado de transición.
- Aspectos energéticos.
- Cinética química. Factores que influyen en la velocidad de reacción.
- Equilibrio químico.
5.2. La ecuación química.
- Ajuste por tanteo y por el método matemático.
5.3. Tipos de reacciones químicas.
5.4. Cálculos estequiométricos.
- Repaso conceptos
5.1. ¿Qué es una reacción química?
- Teoría de las colisiones y teoría del estado de transición.
- Aspectos energéticos.
- Cinética química. Factores que influyen en la velocidad de reacción.
- Equilibrio químico.
5.2. La ecuación química.
- Ajuste por tanteo y por el método matemático.
5.3. Tipos de reacciones químicas.
5.4. Cálculos estequiométricos.
- Repaso conceptos
5.1. ¿QUÉ ES UNA REACCIÓN QUÍMICA?
- Definición:
Se denomina reacción química a la transformación de unas sustancias (REACTIVOS) en otras diferentes (PRODUCTOS) si se ponen en contacto en determinadas condiciones (de presión, temperatura, etc.).
A diferencia de los cambios físicos (cambios de estado, disolución), en los cambios químicos se modifica la naturaleza de las sustancias, es decir, cambian las fórmulas químicas. Los reactivos y productos tienen fórmula diferente.

A nivel molecular, en una reacción química se rompen unos enlaces (H-H y O-O) y se forman otros (H-O-H).
Hay reacciones químicas que van acompañadas de cambios muy notorios: explosiones, aparición de humo, desprendimiento de luz, formación/desaparición de un sólido, etc.

A nivel molecular, en una reacción química se rompen unos enlaces (H-H y O-O) y se forman otros (H-O-H).
Hay reacciones químicas que van acompañadas de cambios muy notorios: explosiones, aparición de humo, desprendimiento de luz, formación/desaparición de un sólido, etc.
- La teoría de las colisiones:
Es una teoría basada en la teoría cinético-molecular. Afirma que una reacción química se produce como resultado del choque de dos o más moléculas de reactivo. Pero no todo los choques dan lugar a la reacción, solo los choques eficaces:
- Las moléculas que alcanzan una energía cinética suficiente para romper los enlaces de reactivos (energía de activación).
- Las moléculas que chocan con la orientación adecuada.
- Las moléculas que alcanzan una energía cinética suficiente para romper los enlaces de reactivos (energía de activación).
- Las moléculas que chocan con la orientación adecuada.
Tras los choques, los átomos libres se reorganizan formando las nuevas moléculas: los productos.
Ejemplo: Formación del ácido yodhídrico.
- La teoría del estado de transición:
Supone que tras los choques eficaces se forma un compuesto intermedio llamado COMPLEJO ACTIVADO o de transición: moléculas que han roto parte de sus enlaces iniciales y están formando otros nuevos.
La energía de activación es la energía necesaria para formar el complejo activado. Debido a su elevada energía, este complejo es muy inestable y se descompone inmediatamente originando los productos o regenerando los reactivos.
La energía de activación es la energía necesaria para formar el complejo activado. Debido a su elevada energía, este complejo es muy inestable y se descompone inmediatamente originando los productos o regenerando los reactivos.
VIDEO:
- Aspectos energéticos:
La rotura y formación de enlaces hacen que se produzca un intercambio de energía en forma de calor:
- Si en el proceso global de la reacción se desprende energía, la reacción se llama EXOTÉRMICA. Ejemplo: Reacciones de formación como la formación del agua.
- Sin embargo, si para que tenga lugar la transformación se necesita un aporte de energía (por ej., en forma de calor), la reacción se denomina ENDOTÉRMICA. Ejemplo: Reacciones de descomposición como la descomposición del H2O.
Reacción exotérmica
Reacción endotérmica
- Para trabajar con las reacciones químicas que tienen lugar a presión constante utilizamos una función de estado llamada ENTALPÍA. La variación de entalpía de una reacción química es igual al calor de reacción. Al ser una función de estado nos permite asegurar que el calor absorbido o cedido en una reacción no depende del proceso de la reacción, sino únicamente del estado inicial y final del sistema. El signo de la variación de entalpía nos permite determinar el carácter exotérmico o endotérmico de una reacción: negativa, si el sistema pierde energía (cede calor al entorno); o positiva, si el sistema gana energía en forma de calor. Existen valores tabulados en condiciones estándar de presión y temperatura (1 atm y 25º C ó 298,16 K). ∆H = Qp
- Aplicando la ley de Hess o ley de la aditividad de los calores de reacción podemos calcular el calor absorbido o cedido sumando el puesto en juego en varias etapas.
De esta parte de la Química se encarga la TERMODINÁMICA
- Cinética química. Factores que influyen en la velocidad:
La cinética química es la parte de la Química que trata la velocidad de las reacciones. Se denomina velocidad de una reacción a la rapidez con que los reactivos se transforman en productos. Se puede estudiar siguiendo la cantidad de reactivo que desaparece por unidad de tiempo, o bien, la cantidad de producto que se forma por unidad de tiempo.
Así hablamos de reacciones lentas como la oxidación de un trozo de hierro o rápidas como una combustión.
Así hablamos de reacciones lentas como la oxidación de un trozo de hierro o rápidas como una combustión.
¿Cómo podríamos aumentar la velocidad de una reacción química? FACTORES:
- Aumentando la temperatura. A mayor energía de los reactivos mayor número de moléculas activadas y más fácilmente se romperán los enlaces pues habrá mayor número de choques eficaces.
- Aumentando la concentración de los reactivos. Se facilita que las partículas se encuentren y choquen entre sí. A mayor número de choques eficaces, mayor velocidad de reacción.
- Aumentando el grado de división. Si en una reacción interviene un sólido, se incremennta su superficie de contacto y la probabilidad de choques eficaces.
- Añadiendo catalizadores, Son sustancias que disminuyen la energía de activación. No intervienen en la reacción (no reaccionan) y se recuperan inalterados al final del proceso.
No obstante, a veces interesa ralentizar una reacción química, como ocurre en la conservación de los alimentos, en la oxidación de metales, etc. Para ello, reducimos la temperatura (frigorífico) o protegemos con una capa de pinturas. También existen catalizadores que disminuyen la velocidad de las reacciones químicas (inhibidores o catalizadores negativos).
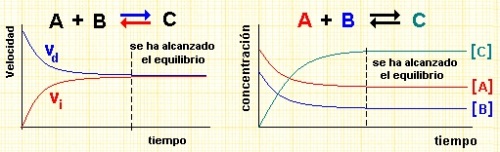
- Equilibrio químico:

Lo que ocurre al variar las condiciones de un sistema en equilibrio fue descrito en 1888 por el químico francés Le Chatelier. El principio de Le Chatelier dice que: "Una alteración de los factores (temperatura, presión, concentraciones) que intervienen en un equilibrio induce un ajuste del sistema para reducir el efecto de dicha alteración y establecer un nuevo equilibrio".
5.2. LA ECUACIÓN QUÍMICA
- ¿Qué es?
Una ecuación química es la representación escrita y abreviada del proceso de transformación al que describe cualitativa y cuantitativamente.
A + B → C + D
Ejemplo: Neutralización ácido-base.
2 HCl (aq) + Ca(OH)2 (aq) → CaCl2 (aq) + 2 H2O (l)
- A la izquierda se escriben las fórmulas de los reactivos, a la derecha las de los productos, y entre ambas, una flecha que indica la transformación y se lee "para dar". (Doble flecha indicaría proceso reversible).
- Delante de cada fórmula se escribe un número (coeficiente estequiométrico), que indica la proporción en moléculas o en moles en la que interviene esa sustancia en la reacción.
- Detrás de cada fórmula y entre paréntesis se suele indicar el estado físico de las sustancias que intervienen: sólido (s), líquido (l), gaseoso (g) o en disolución acuosa (aq)
La reacción del ejemplo se lee: "2 moles de ácido clorhídrico en disolución acuosa reaccionan con 1 mol de hidróxido de calcio en disolución acuosa para dar 1 mol de cloruro de calcio en disolución acuosa y 2 moles de agua en estado líquido".
- La ley de la conservación de la masa de Lavoisier (1772): En una reacción química la materia ni se crea ni se destruye, solo se transforma. Masa total reactivos = Masa total productos. En una reacción se conserva el número de átomos de cada elemento y la masa, solo cambian las sustancias. Por eso los reactivos y productos tienen fórmula distinta.
- El ajuste de las ecuaciones químicas:
Ajustar, equilibrar o balancear una ecuación química es encontrar los coeficientes estequiométricos de cada una de las sustancias de la reacción para que se cumpla que el número de cada elemento químico en los reactivos sea el mismo que en los productos.
Ejemplo de reacción ajustada, la ecuación de formación del amoniaco: N2(g) + 3 H2(g) → 2NH3 (g)
El ajuste de ecuaciones químicas sencillas se realiza "por tanteo" (ensayo-error), el de ecuaciones más complicadas por el "método algebraico o matemático". Este último nunca falla.


En el caso de las reacciones de combustión existe un orden para facilitar el ajuste: 1º C;, 2º H y,3º O
VIDEO: Ejemplo de ambos métodos
5.3. TIPOS DE REACCIONES QUÍMICAS.
Existen distintos tipos de reacciones químicas, algunos ejemplos son:
a) Reacción de formación o de síntesis: la combinación de 2 o más sustancias (elementos o compuestos) para formar un solo compuesto.
A + B → C
Ejemplo: 4 Al (s) + 3O2 (g) → 2Al2O3 (s)
b) Reacciones de descomposición: Una sustancia se descompone en otras más sencillas.
A → B + C
Ejemplo: 2 KClO3 (s) → 2 KCl(s) + 3 O2 (g) que se produce al calentar el clorato de potasio.
c) Reacciones de desplazamiento sencillo: un elemento químico reemplaza a otro similar menos reactivo.
AB + C → AC + B
Ejemplo: Mg (s) + CuSO4 (ac) →MgSO4 (ac) + Cu (s)
d) Reacción de doble desplazamiento químico: Los átomos o iones de reactivos intercambian su posición originando otros productos.
AB + CD → AD + CB
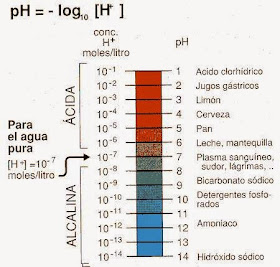
Un ejemplo son las reacciones de neutralización. Cuando reaccionan entre sí ácidos y bases para dar lugar, siempre, a una sal y agua: H2SO4 (aq) + 2 NaOH (aq) → Na2SO4(aq) + 2 H2O (l)
Escala de pH
Otro ejemplo de doble desplazamiento en el que el hidrógeno remplaza a la plata.
AgNO3(aq) + HCl (ac) → HNO3 (aq) + AgCl (s)
e) Reacciones de combustión: Son reacciones químicas en las que una sustancia llamada combustible (hidrocarburo formado por H y C), reacciona con otra, llamada corburente (normalmente el oxígeno del aire) desprendiéndose gran cantidad de energía y, siempre, dióxido de carbono y agua. La reacciones de combustión son un tipo de reacción de óxido-reducción. En las que uno de los reactivos se reduce y el otro se oxida.
.
Combustible (hidrocarburo*, madera, materia orgánica,...) + O2 → CO2 + H2O
*Ejemplos de hidrocarburos
Recuerda que el CO2 es uno de los principales responsables del efecto invernadero (artificial) y está directamente implicado en el cambio climático.
En el ajuste de estas reacciones por el método de tanteo se sigue el siguiente orden: 1º el carbono, 2º el hidrógeno y 3º el oxígeno para el final.
EJEMPLOS: Ajusta la combustión de la glucosa (C6H12O6) y la combustión del gas butano (C4H10)
EJEMPLOS: Ajusta la combustión de la glucosa (C6H12O6) y la combustión del gas butano (C4H10)
5.4. CÁLCULOS ESTEQUIOMÉTRICOS.
- Los cálculos que se refieren a las cantidades de sustancias que intervienen en una reacción química se denominan cálculos estequiométricos. El origen de la palabra ESTEQUIOMETRÍA es muy interesante.
La interpretación cuantitativa de una ecuación química nos permite calcula la masa o el volumen (en el caso de gases) de sustancias implicadas a partir de otras. Para poder realizar cálculos la ecuación química debe estar ajustada.
Pero, ¿qué conocimientos previos debo tener para realizar cálculos?
- Calcular a partir de las masas atómicas relativas la masa molecular relativa de las sustancias a partir de datos del problema o de la tabla periódica.
- Conocer la relación entre masa molecular relativa a masa molar.
- El concepto de mol y el número de Avogadro.
- Las condiciones normales de presión y temperatura para la IUPAC son 1 atm y 273 K ( 0º C). Un mol de cualquier gas ocupa 22,4 L en c.n.
- La ecuación de Clapeyron o de estado de los gases ideales, me permite relacionar Volúmenes, moles y masas: pV = nRT.
- La molaridad de una disolución es una forma de expresar su concentracion. Así, 2 M (se lee 2 molar) significa que hay 2 moles de soluto por cada litro de disolución: 2 mol/L.
- Utilizar factores de conversión.
- Los cálculos que se refieren a las cantidades de sustancias que intervienen en una reacción química se denominan cálculos estequiométricos. El origen de la palabra ESTEQUIOMETRÍA es muy interesante.
La interpretación cuantitativa de una ecuación química nos permite calcula la masa o el volumen (en el caso de gases) de sustancias implicadas a partir de otras. Para poder realizar cálculos la ecuación química debe estar ajustada.
Pero, ¿qué conocimientos previos debo tener para realizar cálculos?
- Calcular a partir de las masas atómicas relativas la masa molecular relativa de las sustancias a partir de datos del problema o de la tabla periódica.
- Conocer la relación entre masa molecular relativa a masa molar.
- El concepto de mol y el número de Avogadro.
- Las condiciones normales de presión y temperatura para la IUPAC son 1 atm y 273 K ( 0º C). Un mol de cualquier gas ocupa 22,4 L en c.n.
- La ecuación de Clapeyron o de estado de los gases ideales, me permite relacionar Volúmenes, moles y masas: pV = nRT.
- La molaridad de una disolución es una forma de expresar su concentracion. Así, 2 M (se lee 2 molar) significa que hay 2 moles de soluto por cada litro de disolución: 2 mol/L.
- Utilizar factores de conversión.
- UNIDAD DE MASA ATÓMICA (u): La masa del átomo coincide con la suma de su número de protones y neutrones (nucleones).
- MASA MOLECULAR RELATIVA (Mr): Es la suma de la masa atómica relativa de cada uno de los elementos de un compuesto. Ej: Mr (NH3 ) = A (N) + 3. A (H) = 14 + 3.1 = 17 u. La masa molecular del amoniaco es 17 u. La masa molar (la masa de un mol de sustancia) del amoniaco es 17 g
Ejercicio: Calcula la masa molecular relativa y la masa molar de
a) HNO3 b) H2SO4 c) O2 d) H2 e) NH3 f) C6H12O6
- EL MOL: Un mol es la cantidad de sustancia que puede contener tantas unidades elementales (átomos, moléculas, iones, electrones, ...) como átomos contienen 0,012 kg de carbono 12. Este número es una constante que se conoce como número de Avogadro (NA) como 6,022.1023. La masa en gramos de un mol de átomos (o la masa molar expresada en gramos, en el caso de moléculas) es numéricamente igual a la masa atómica (molecular) expresada en unidades de masa atómica. Es decir, un átomo de oxígeno tiene la masa atómica de 16 u, luego su masa molar (la de 1 mol de átomos) es 16 gramos. De otra forma: cuando tenemos 18 g de agua, tenemos un mol de agua y su masa molecular relativa será 18 u.
1 mol de átomos de C-12 = 6,022·1023átomos de C-12
1 mol de moléculas de H2O = 6,022·1023moléculas de H2O
1 mol de iones NO3¯ = 6,022·1023iones NO3¯
- El REACTIVO LIMITANTE es aquel que cuando se consume totalmente, se detiene la reacción. Al otro que queda sin reaccionar cuando esto ocurre se le denomina REACTIVO EN EXCESO.
- El RENDIMIENTO DE UNA REACCIÓN es el cociente entre la cantidad de producto obtenida y la cantidad que esperábamos teóricamente. Se expresa en tanto por ciento
- ACTIVIDADES REPASO MOLES, MASA, ÁTOMOS y MOLÉCULAS:
- Ejercicio 1: Un átomo de aluminio tiene masa 27 u, ¿cuántos gramos son 3 moles de aluminio?1º Podemos escribir 27 g/mol (a efectos del cálculo)2º Utilizamos factor de conversión para calcularlo: 27 g/mol . 3 mol = 81 g es la masa del Al
Ejercicio 2: Tenemos 30 g de amoníaco: a) ¿Cuántos moles tenemos? b) ¿Cuántas moléculas? c) Cuántos moles de H tenemos? d) ¿Cuántos átomos de H tenemos? e) ¿Cuántos gramos de H tenemos? f) ¿Cuántos gramos de NH3 necesitamos para tener 5 g de H? g) Si tenemos 5,1024 moléculas de NH3, ¿cuántos gramos de H tenemos? (Sol: 1,76 mol; 1,06.1024 moléculas; 5,28 moles de H; 3,18.1024 átomos de H; 5,29g; 28,33 g; 24,91 g)
Ejercicio 3: El ozono es una molécula formada por tres átomos de oxígeno. Está considerada como un contaminante cuando se encuentra en la baja atmósfera, en cambio en la estratosfera nos protege de los rayos UV del Sol. Si en una muestra de laboratorio hay 96 g de ozono, calcula: a) La masa molecular del Ozono; b) El número de moles; c) El número de moléculas; d) El número de átomos de oxígeno. (Sol: 48 u; 2 mol; 1,204.10^24 moléculas de O3; 3,613.10^24 átomos de O)
PROFUNDIZACIÓN: aquí






No hay comentarios:
Publicar un comentario